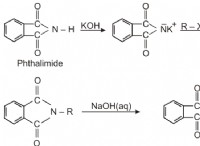
Τι κάνει τα δύο ισότοπα του ίδιου στοιχείου διαφορετικό μεταξύ τους;
Εδώ είναι μια κατανομή:
* Στοιχείο: Που ορίζεται από τον αριθμό των πρωτονίων στον πυρήνα του. Για παράδειγμα, όλα τα άτομα άνθρακα έχουν 6 πρωτόνια.
* Isotope: Άτομα του ίδιου στοιχείου με τον ίδιο αριθμό πρωτονίων αλλά * διαφορετικούς * αριθμούς νετρονίων.
Ας εξετάσουμε δύο κοινά ισότοπα άνθρακα:
* Carbon-12: Έχει 6 πρωτόνια και 6 νετρόνια.
* Carbon-14: Έχει 6 πρωτόνια και 8 νετρόνια.
Και οι δύο είναι άνθρακας επειδή έχουν 6 πρωτόνια, αλλά έχουν διαφορετικές ατομικές μάζες (12 και 14) λόγω της διαφοράς στα νετρόνια.
Βασικά σημεία:
* Τα ισότοπα έχουν τις ίδιες χημικές ιδιότητες αφού έχουν τον ίδιο αριθμό ηλεκτρονίων (και επομένως την ίδια αντιδραστικότητα).
* Τα ισότοπα έχουν διαφορετικές φυσικές ιδιότητες (όπως η μάζα) λόγω του ποικίλου αριθμού νετρονίων.
* Τα ισότοπα χρησιμοποιούνται συχνά σε διάφορες εφαρμογές, όπως η χρονολόγηση άνθρακα (χρησιμοποιώντας άνθρακα-14) και ιατρική απεικόνιση (χρησιμοποιώντας ιώδιο-131).