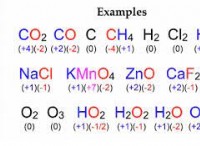
Εξηγήστε γιατί ένας αριθμός οξείδωσης σχετίζεται με την ομάδα σε περιοδική ιστορία που ανήκει;
Εδώ είναι η σύνδεση:
* Αριθμός ομάδας: Ο αριθμός ομάδας ενός στοιχείου στον περιοδικό πίνακα γενικά υποδεικνύει τον αριθμό των ηλεκτρονίων σθένους που έχει ένα στοιχείο. Για παράδειγμα, τα στοιχεία της ομάδας 1 (αλκαλικά μέταλλα) έχουν ένα ηλεκτρόνιο σθένους, ενώ τα στοιχεία της ομάδας 17 (αλογόνα) διαθέτουν επτά ηλεκτρόνια σθένους.
* Τάση να κερδίζετε ή να χάσετε ηλεκτρόνια: Τα στοιχεία τείνουν να κερδίζουν ή να χάνουν ηλεκτρόνια για να επιτύχουν ένα σταθερό οκτάτο (8 ηλεκτρόνια) στο εξώτατο κέλυφος τους. Τα στοιχεία στην αριστερή πλευρά του περιοδικού πίνακα (μέταλλα) έχουν την τάση να χάνουν ηλεκτρόνια, ενώ τα στοιχεία στη δεξιά πλευρά (μη μέταλλα) τείνουν να κερδίζουν ηλεκτρόνια.
* Αριθμός οξείδωσης: Ο αριθμός οξείδωσης αντικατοπτρίζει τον αριθμό των ηλεκτρονίων που ένα στοιχείο έχει κερδίσει, χαθεί ή μοιράζεται σε μια ένωση.
* μέταλλα: Τα μέταλλα έχουν συνήθως θετικούς αριθμούς οξείδωσης επειδή χάνουν ηλεκτρόνια για να επιτύχουν μια σταθερή διαμόρφωση. Ο αριθμός οξείδωσης ενός μετάλλου συχνά αντιστοιχεί στον αριθμό της ομάδας. Για παράδειγμα, το νάτριο (NA) στην ομάδα 1 συνήθως έχει αριθμό οξείδωσης +1.
* Μη μετάλλια: Τα μη μέταλλα έχουν συνήθως αρνητικούς αριθμούς οξείδωσης επειδή κερδίζουν ηλεκτρόνια για να επιτύχουν μια σταθερή διαμόρφωση. Ο αριθμός οξείδωσης ενός μη μέταλλου σχετίζεται με τον αριθμό των ηλεκτρονίων που χρειάζεται για να κερδίσει για να φτάσει σε ένα σταθερό οκτάτο. Για παράδειγμα, το χλώριο (CL) στην ομάδα 17 συνήθως έχει έναν αριθμό οξείδωσης -1.
Σημαντικές σημειώσεις:
* Εξαιρέσεις: Υπάρχουν εξαιρέσεις από αυτές τις γενικές τάσεις, ειδικά για μεταβατικά μέταλλα που μπορούν να έχουν πολλαπλές καταστάσεις οξείδωσης.
* ομοιοπολικές ενώσεις: Οι αριθμοί οξείδωσης σε ομοιοπολικές ενώσεις αποδίδονται με βάση τις διαφορές ηλεκτροαρνητικότητας, με το πιο ηλεκτροαρνητικό άτομο να αποδίδει αρνητικό αριθμό οξείδωσης.
Συνοπτικά:
Ο αριθμός της ομάδας στον περιοδικό πίνακα παρέχει μια ένδειξη του αριθμού των ηλεκτρονίων σθένους που έχει ένα στοιχείο, το οποίο με τη σειρά του επηρεάζει την τάση του να κερδίζει ή να χάνει ηλεκτρόνια. Αυτή η τάση να κερδίζει ή να χάνει ηλεκτρόνια καθορίζει άμεσα τον αριθμό οξείδωσης του στοιχείου σε ενώσεις.