Ο Περιοδικός Πίνακας
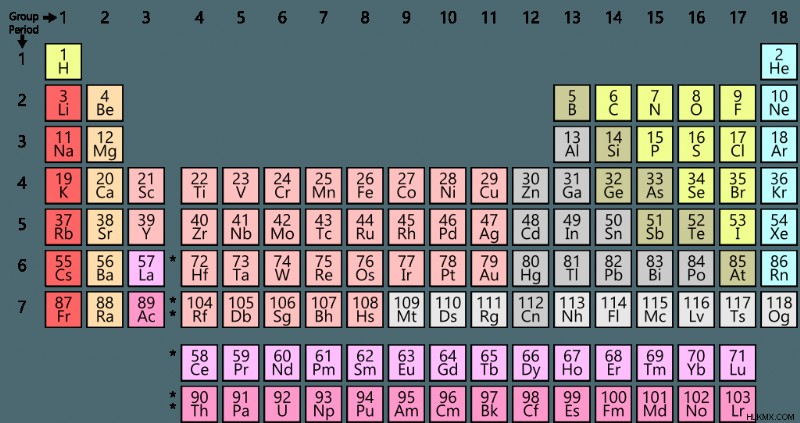
Ο περιοδικός πίνακας είναι μια διάταξη πίνακα των χημικών στοιχείων, ταξινομημένων κατά ατομικό αριθμό. Οι στήλες και οι σειρές στις οποίες είναι διατεταγμένος ο περιοδικός πίνακας προορίζονται να αντικατοπτρίζουν τις επαναλαμβανόμενες τάσεις στη δομή, τη διαμόρφωση ηλεκτρονίων και τις χημικές ιδιότητες των στοιχείων.
Ο περιοδικός πίνακας είναι μια οπτική αναπαράσταση των γνώσεών μας για τα βασικά συστατικά της συνηθισμένης ύλης και πώς οι συμπεριφορές τους σχετίζονται με την πυρηνική και τη δομή των ηλεκτρονίων τους. Η οργάνωση του περιοδικού πίνακα μπορεί να χρησιμοποιηθεί για να εξηγήσει τις ομοιότητες μεταξύ στοιχείων στην ίδια γραμμή ή στήλη και να προβλέψει τις ιδιότητες των μη ανακαλυφθέντων στοιχείων. Μέχρι σήμερα, υπάρχουν 118 μοναδικά χημικά στοιχεία στον περιοδικό πίνακα, 94 από τα οποία εμφανίζονται φυσικά στη Γη. Τα υπόλοιπα 24 είναι συνθετικά στοιχεία που έχουν παραχθεί μόνο στο εργαστήριο.
Βασική επισκόπηση του περιοδικού πίνακα
Στην πιο βασική του δομή, τα στοιχεία στον περιοδικό πίνακα είναι διατεταγμένα διαδοχικά σύμφωνα με τον αυξανόμενο ατομικό αριθμό. Ο ατομικός αριθμός αντιστοιχεί στον αριθμό των πρωτονίων σε ένα άτομο αυτού του στοιχείου. Το υδρογόνο, για παράδειγμα, έχει ατομικό αριθμό 1 και έτσι ένα άτομο υδρογόνου έχει 1 πρωτόνιο. Ο αριθμός των πρωτονίων καθορίζει την ταυτότητα του στοιχείου, επομένως ο ατομικός αριθμός κάθε στοιχείου είναι μοναδικός. Τα περισσότερα στοιχεία έχουν ισότοπα, άτομα με διαφορετικές ποσότητες νετρονίων. Τα ισότοπα ταξινομούνται όλα στο ίδιο στοιχείο σύμφωνα με τον αριθμό πρωτονίων.
Κάθε τετράγωνο στον πίνακα ανήκει σε ένα ένα στοιχείο. Σε γενικές γραμμές, Κάθε τετράγωνο επισημαίνεται με ένα μοναδικό ατομικό σύμβολο, ατομικό αριθμό και ορισμένες πληροφορίες σχετικά με το στοιχείο, όπως το όνομά του και το ατομικό του βάρος. Με άλλα λόγια, κάθε τετράγωνο είναι σαν μια περίληψη βασικών πληροφοριών σχετικά με αυτό το στοιχείο.

Τα στοιχεία είναι διατεταγμένα από αριστερά προς τα δεξιά διαδοχικά σύμφωνα με τον ατομικό αριθμό και μια νέα σειρά σχηματίζεται όταν το επόμενο στοιχείο έχει ηλεκτρόνια που γεμίζουν ένα νέο υποκέλυφος. Η επαναλαμβανόμενη δομή ταξινομεί τα στοιχεία σε γραμμές και στήλες που ονομάζονται περίοδοι και ομάδες, αντίστοιχα.
Περίοδοι
Κάθε στοιχείο στην ίδια περίοδο έχει ηλεκτρόνια σθένους που καταλαμβάνουν το ίδιο υποκέλυφος ηλεκτρονίων. Για παράδειγμα, όλα τα στοιχεία στην περίοδο 4 έχουν εξωτερικά ηλεκτρόνια που γεμίζουν το 4ο υποκέλυφος ηλεκτρονίων. Κάθε επόμενο στοιχείο της περιόδου έχει ένα πρωτόνιο περισσότερο από το προηγούμενο στοιχείο. Ως αποτέλεσμα αυτής της διάταξης, πηγαίνοντας από αριστερά προς τα δεξιά σε μια μεμονωμένη περίοδο, υπάρχουν περιοδικές τάσεις στις ιδιότητες των στοιχείων. Η περίοδος 1 είναι η μικρότερη και αποτελείται μόνο από 2 στοιχεία (υδρογόνο και ήλιο)
Γενικά, τα στοιχεία προς τα αριστερά έχουν μεγαλύτερη ατομική ακτίνα, ασθενέστερη ενέργεια ιονισμού και πιο μεταλλικό χαρακτήρα. Τα στοιχεία προς τα δεξιά τείνουν να έχουν υψηλότερη ηλεκτραρνητικότητα, μικρότερη ατομική ακτίνα και υψηλότερη ενέργεια ιονισμού. Αυτή η τάση είναι αποτέλεσμα της διαδοχικής αύξησης των πρωτονίων και των ηλεκτρονίων σε κάθε επόμενο στοιχείο. Καθώς τα άτομα αποκτούν περισσότερα πρωτόνια, ο πυρήνας του ατόμου έλκεται ισχυρότερα στα γύρω ηλεκτρόνια, δίνοντας μια μικρότερη ατομική ακτίνα. Όταν τα ηλεκτρόνια αρχίζουν να κατοικούν σε ένα άλλο κέλυφος ηλεκτρονίων, η τάση επαναλαμβάνεται. Η έναρξη μιας νέας περιόδου σημαίνει ότι τα άτομα σε αυτήν την περίοδο γεμίζουν διαφορετικό κέλυφος σθένους από εκείνα της προηγούμενης. Οι τάσεις σε περιόδους μπορούν να χρησιμοποιηθούν για την πρόβλεψη των ιδιοτήτων άγνωστων στοιχείων. Υπάρχουν επί του παρόντος 7 διακριτές περίοδοι στον περιοδικό πίνακα. Πολλά από τα στοιχεία της περιόδου 7 δεν υπάρχουν φυσικά και πρέπει να συντεθούν στο εργαστήριο.
Ομάδες
Ως αποτέλεσμα της οριζόντιας οργάνωσης των στοιχείων αυξάνοντας τον αριθμό πρωτονίων και τα κελύφη ηλεκτρονίων, τα στοιχεία διατάσσονται επίσης σε κάθετες στήλες που ονομάζονται ομάδες ή οικογένειες. Τα στοιχεία της ίδιας ομάδας έχουν παρόμοιες δομές ηλεκτρονίων και έτσι τείνουν να είναι χημικά παρόμοια. Για παράδειγμα, τα στοιχεία της 17ης ομάδας, που ονομάζονται αλογόνα, έχουν ένα κέλυφος σθένους με 7 ηλεκτρόνια. Ως αποτέλεσμα, είναι όλα πολύ ηλεκτραρνητικά και αντιδραστικά, και θα σχηματίσουν εύκολα ιοντικούς δεσμούς με μέταλλα. Ομοίως, στοιχεία της 18ης ομάδας, που μερικές φορές ονομάζονται ευγενή αέρια, έχουν ένα πλήρες υποκέλυφος ηλεκτρονίων και επομένως είναι χαρακτηριστικά αδρανή και μη αντιδραστικά
Υπάρχουν 18 ομάδες στον περιοδικό πίνακα (οι ομάδες στο μπλοκ f δεν υπολογίζονται στο σύνολο). Πολλές ομάδες έχουν συγκεκριμένα ονόματα όπως αλκαλικά μέταλλα της ομάδας 1 και χαλκογόνα της ομάδας 16. Η ομαδική δομή του περιοδικού πίνακα καθιστά δυνατή την πρόβλεψη των χημικών ιδιοτήτων άγνωστων στοιχείων στην ίδια ομάδα από την επόμενη περίοδο.
Τρόποι Ομαδοποίησης Στοιχείων
Μπλοκ
Εκτός από τη βασική διάταξη γραμμής/στήλης του περιοδικού πίνακα, τα στοιχεία μπορούν επίσης να ομαδοποιηθούν σε ξεχωριστά «μπλοκ», το καθένα που αντιστοιχεί σε ομοιότητες στη διαμόρφωση ηλεκτρονίων. Για παράδειγμα, στοιχεία στο μπλοκ p, το μπλοκ στην πιο δεξιά πλευρά του πίνακα, έχουν ηλεκτρόνια σθένους στο p-τροχιακό υποφλοιό τους. Τα άλλα μπλοκ ονομάζονται s, d και f, σε σχέση με τα τροχιακά σθένους τους.
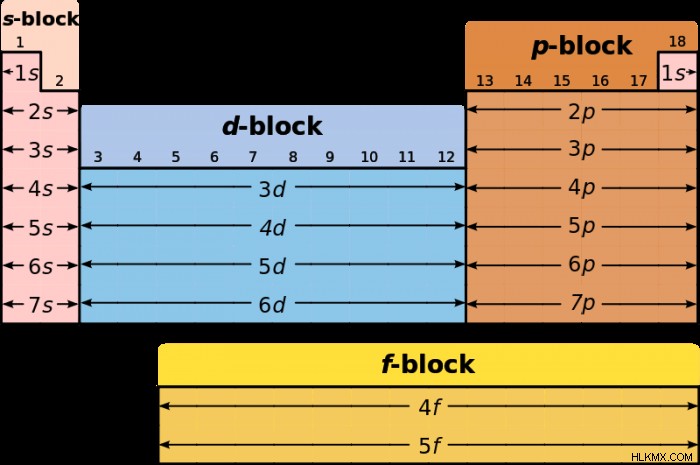
Κάθε μπλοκ αντιστοιχεί στο υποκέλυφος που γεμίζει το τελευταίο ηλεκτρόνιο του φλοιού. Το μπλοκ s περιέχει τα μέταλλα αλκαλίων της ομάδας 1 και τα μέταλλα των αλκαλικών γαιών της ομάδας 2. Το μπλοκ d αντιστοιχεί στην πλειονότητα των μετάλλων μετάπτωσης και σε ορισμένα ημιμέταλλα, ενώ το μπλοκ p αντιστοιχεί σε κοινά στοιχεία όπως το άζωτο, το οξυγόνο, ο άνθρακας και το θείο. Τα στοιχεία f-block αντιστοιχούν στη σειρά λανθανιδών και ακτινιδών, δύο αλληλουχίες στοιχείων μεγάλων πυρήνων, πολλά από τα οποία είναι ραδιενεργά.
Μέταλλα, Αμέταλλα και Μεταλλοειδή
Τα στοιχεία συχνά ομαδοποιούνται στην ταξινόμηση μετάλλων, μη μετάλλων και μεταλλοειδών, σύμφωνα με τις χημικές και φυσικές τους ιδιότητες.
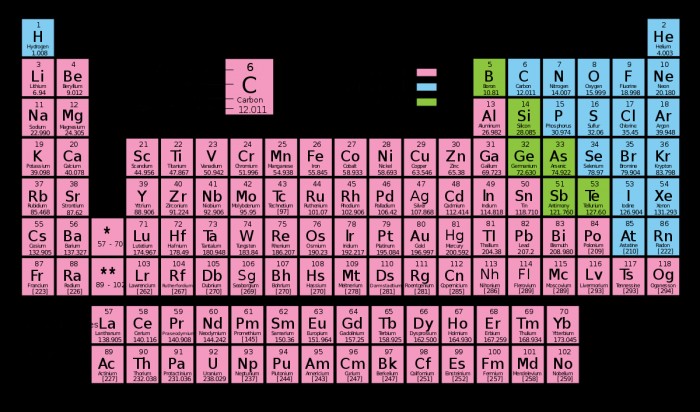
Μέταλλα , όπως θα υπονοούσε το όνομα, είναι στοιχεία που έχουν μεταλλικό χαρακτήρα. Τείνουν να είναι όλκιμοι, εύπλαστοι, άγουν τη θερμότητα και τον ηλεκτρισμό, έχουν γυαλιστερή λάμψη, σχηματίζουν θετικά ιόντα και σχηματίζουν μεταλλικούς δεσμούς με άλλα μέταλλα. Τα περισσότερα μέταλλα εμφανίζονται προς τα αριστερά και προς τα κάτω στον περιοδικό πίνακα. Στην πραγματικότητα, τα περισσότερα από τα στοιχεία του περιοδικού πίνακα θεωρούνται μέταλλα. 91 από τα 118 γνωστά στοιχεία ταξινομούνται ως μέταλλα.
Μη μέταλλα αποτελούν την πλειοψηφία των υπολοίπων στοιχείων. Τα μη μέταλλα έχουν μια κιμωλιακή υφή και τείνουν να είναι εύθραυστα, φτωχοί αγωγοί θερμότητας και ηλεκτρισμού, έχουν υψηλές ηλεκτραρνητικότητα και υψηλές ενέργειες ιονισμού. Τα μη μέταλλα τείνουν να σχηματίζουν ομοιοπολικούς ή ιοντικούς δεσμούς τόσο με μέταλλα όσο και με άλλα αμέταλλα. Η πλειοψηφία των κοινών καθημερινών στοιχείων όπως το οξυγόνο, ο άνθρακας, το άζωτο, ο φώσφορος και το φθόριο είναι αμέταλλα.
Μεταλλοειδή καταλαμβάνουν μια περίεργη μέση λύση μεταξύ μετάλλων και αμετάλλων. Τα μεταλλοειδή έχουν μεταλλική εμφάνιση και είναι αξιοπρεπείς αγωγοί του ηλεκτρισμού, αλλά είναι εύθραυστα και όχι τόσο εύπλαστα όσο τα μέταλλα. Γενικά, τα μεταλλοειδή έχουν ιδιότητες μεταξύ μετάλλων και μη μετάλλων. Τα 6 κοινώς αναγνωρισμένα μεταλλοειδή είναι το βόριο, το πυρίτιο, το γερμάνιο, το αρσενικό, το αντιμόνιο και το τελλούριο. Μερικές φορές οι χημικοί περιλαμβάνουν σελήνιο ή αλουμίνιο ως μεταλλοειδή, ανάλογα με τους σκοπούς τους.
Τάσεις σε όλο τον πίνακα
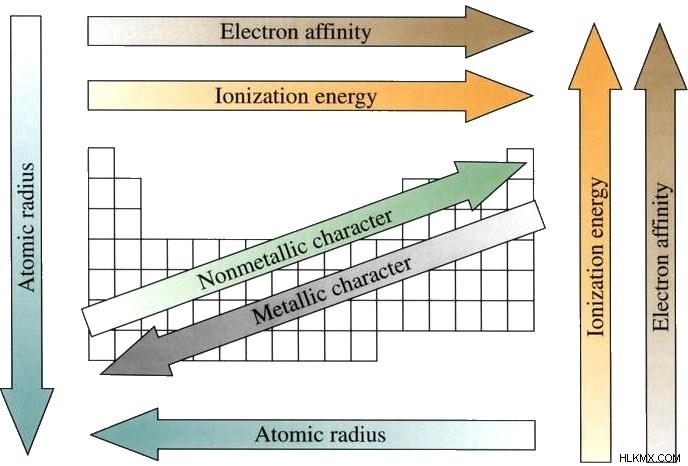
Η επαναλαμβανόμενη δομή του περιοδικού πίνακα περιγράφει επαναλαμβανόμενες τάσεις στις φυσικές και χημικές ιδιότητες των στοιχείων. Για παράδειγμα, τα στοιχεία στα αριστερά του πίνακα τείνουν να έχουν πιο μεταλλικό χαρακτήρα, ενώ εκείνα στα δεξιά έχουν έναν πιο μη μεταλλικό χαρακτήρα. Τα στοιχεία προς τα δεξιά τείνουν να έχουν υψηλότερες ενέργειες ιονισμού και υψηλότερες ηλεκτραρνητικότητες. Αυτές οι επαναλαμβανόμενες τάσεις οφείλονται στη διαδοχική αύξηση του μεγέθους του πυρήνα και στον περιοδικό τρόπο με τον οποίο τα άτομα γεμίζουν τα ηλεκτρονιακά κελύφη τους. Η γνώση αυτών των τάσεων μπορεί να χρησιμοποιηθεί για την πρόβλεψη των ιδιοτήτων άγνωστων στοιχείων.
Ωστόσο, η ακρίβεια της παραίτησης από τις τάσεις, τόσο υψηλότερη είναι αυτή στον περιοδικό πίνακα. Όλα τα στοιχεία πάνω από το πλουτώνιο (ατομικό αρ. 94) παράγονται συνθετικά και δεν υπάρχουν στη φύση. Αυτά τα συνθετικά στοιχεία μπορεί να έχουν εκπληκτικές ιδιότητες που έρχονται σε αντίθεση με τις τάσεις στον πίνακα λόγω των τεράστιων ατομικών πυρήνων τους.
Ιστορία του περιοδικού πίνακα
Πριν από την έλευση της σύγχρονης χημείας, οι φυσικοί φιλόσοφοι προσυπέγραψαν μια αριστοτελική άποψη για την ύλη, στην οποία υπάρχουν 4 βασικά στοιχεία:φωτιά, νερό, γη και αέρας. Θεωρήθηκε ότι όλα τα αντικείμενα της καθημερινής εμπειρίας ήταν συνδυασμοί αυτών των 4 βασικών στοιχείων σε ποικίλες αναλογίες. Αν και τα συγκεκριμένα στοιχεία ήταν λανθασμένα, η αριστοτελική θεωρία έκανε σωστή μια σημαντική έννοια. όλη η ύλη αποτελείται από υποκείμενες οντότητες που υπάρχουν σε διακριτές αναλογίες μεταξύ τους. Κατά την αρχαιότητα, οι φυσιοδίφες ανακάλυψαν πολλά διακριτά στοιχεία, όπως τον υδράργυρο και τον φώσφορο, αλλά αγνοούσαν την πραγματική χημική φύση τους.
Μόλις τον 18ο αιώνα ο Antoine Lavoisier εισήγαγε τη σύγχρονη κατανόηση των χημικών στοιχείων ως θεμελιωδών ειδών ουσιών που παίζουν ρόλο στις χημικές αντιδράσεις. Η αρχική αναγνώριση στοιχείων από τον Lavoisier περιελάμβανε πολλά που είναι αποδεκτά σήμερα, όπως το οξυγόνο, ο υδράργυρος υδρογόνου, το θείο και ο ψευδάργυρος.
Στον περιοδικό πίνακα, όπως τον καταλαβαίνουμε σήμερα, δόθηκε για πρώτη φορά η μορφή του από τον Ρώσο χημικό Dmitri Mendeleev το 1869. Ο Mendeleev είχε την εξαιρετική γνώση να ταξινομεί τα γνωστά στοιχεία κατά ατομικό βάρος, δημιουργώντας μια νέα σειρά κάθε φορά που οι παρατηρούμενες χημικές ιδιότητες άρχισαν να επαναλαμβάνονται. Ο Mendeleev άφησε επίσης «κενά» κενά στον πίνακά του για στοιχεία που δεν είχαν ακόμη ανακαλυφθεί.
Το μεθοδικό οργανωτικό σχήμα του Mendeleev του επέτρεψε να προβλέψει τις ιδιότητες των τότε μη ανακαλυφθέντων στοιχείων, παρόλο που δεν είχε καμία γνώση για την υποκείμενη ατομική τους δομή. Παρατηρώντας απλώς τις επαναλαμβανόμενες παρατηρήσιμες ιδιότητες των στοιχείων, δημιούργησε ένα σχήμα οργάνωσης που αργότερα δικαιώθηκε και εξηγήθηκε από την έλευση της σύγχρονης ατομικής θεωρίας και την ανακάλυψη πρωτονίων, ηλεκτρονίων και νετρονίων.




