Στερικό Εμπόδιο
Βασικές έννοιες
Σε αυτό το σεμινάριο, θα μάθετε πώς η φυσική δομή μπορεί να επηρεάσει την αντιδραστικότητα των οργανικών μορίων μέσω στερικής παρεμπόδισης . Επιπλέον, θα μπορείτε να οπτικοποιήσετε αυτήν την έννοια, ακολουθώντας ένα παράδειγμα.
Θέματα που καλύπτονται σε άλλα άρθρα
- Ηλεκτρόφιλα
- Πυρηνόφιλα
- Μοριακή Γεωμετρία
- Αντιδράσεις υποκατάστασης
Λεξιλόγιο
- Ηλεκτρόφιλο μόριο πλούσιο σε ηλεκτρόνια
- Πυρηνόφιλο μόριο φτωχό σε ηλεκτρόνια
- Στειρικό στέλεχος- αύξηση της δυναμικής ενέργειας ενός μορίου λόγω απώθησης ηλεκτρονίων μεγάλων πλευρικών ομάδων
Ορισμός Στερικού Εμποδίου
Το στερικό εμπόδιο είναι μια φράση που χρησιμοποιείται στην οργανική χημεία για να περιγράψει πώς η φυσική δομή ενός μορίου μπορεί να επηρεάσει την ικανότητά του να αντιδρά. Όταν ένα μόριο είναι ογκώδες, δηλαδή έχει πολλαπλούς δεσμούς με ενώσεις ή ομάδες εκτός του υδρογόνου, μπορεί να επιβραδύνει ή ακόμα και να εμποδίσει ένα άλλο μόριο να βρει αποτελεσματικά την επιθυμητή θέση δεσμού σε μια αντίδραση. Ας δούμε ένα παράδειγμα παρακάτω!
Παράδειγμα Στερικού Εμποδίου
Ένας απλός τρόπος για να δείτε τα αποτελέσματα της στερικής παρεμπόδισης είναι μια αντίδραση μεταξύ ενός πυρηνόφιλου και ενός ηλεκτρόφιλου. Μπορούμε να χρησιμοποιήσουμε το ίδιο πυρηνόφιλο, HO, και να αλλάξουμε τον όγκο του ηλεκτρόφιλου προσθέτοντας περισσότερα μεθύλιο ή CH3 ομάδες. Όπως φαίνεται στο παρακάτω διάγραμμα, καθώς περισσότερες ομάδες μεθυλίου προστίθενται στο μόριο, υπάρχει λιγότερος χώρος για να σχηματιστεί ο ομοιοπολικός δεσμός με το ηλεκτρόφιλο. Επομένως, καθώς αυξάνεται ο στερικός όγκος, ένα μόριο μπορεί να εμποδίζεται να εκτελεί διαφορετικές αντιδράσεις.
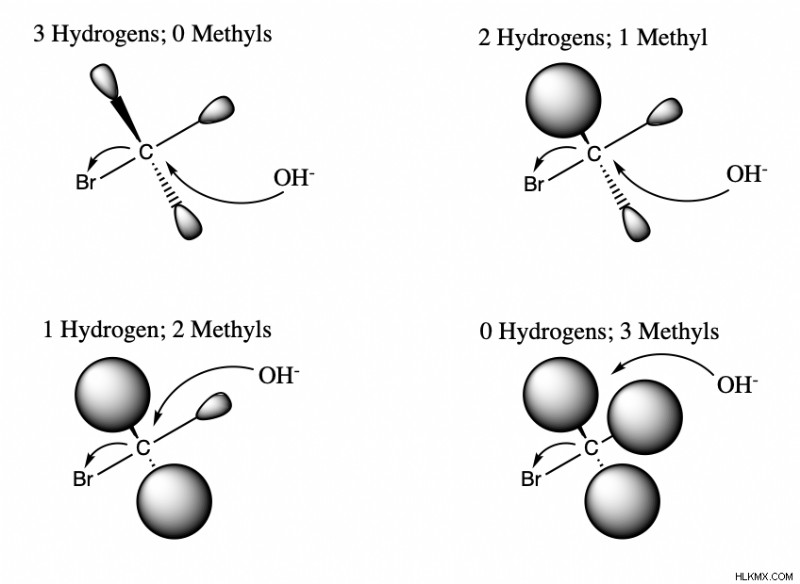
Οι επιπτώσεις της στερικής παρεμπόδισης
Steric Strain
Η χαμηλότερη ενεργειακή μορφή ενός μορίου συνήθως προτιμάται επειδή είναι η πιο φυσική δομή, που σημαίνει ότι υπάρχει μικρή έως καθόλου απώθηση εντός των ομάδων και γωνιακή τάση μεταξύ των δεσμών. Αλλά η στερική καταπόνηση μπορεί να συμβεί όταν υπάρχουν πολλές ογκώδεις ομάδες η μία κοντά στην άλλη σε ένα μόριο. Η ενέργεια χρησιμοποιείται για να εξαναγκάσει τις γωνίες των δεσμών να παραμείνουν με συγκεκριμένο τρόπο, παρόλο που τα ηλεκτρόνια των ομάδων απωθούν το ένα το άλλο.
Επιλεκτικότητα αντίδρασης
Η στερική παρεμπόδιση ενός μορίου μπορεί να χρησιμοποιηθεί για να ευνοήσει μια συγκεκριμένη αντίδραση. Για παράδειγμα, υπάρχουν δύο τύποι αντιδράσεων υποκατάστασης, Sn1 και Sn2. Και οι δύο αυτές αντιδράσεις μπορούν να πραγματοποιηθούν με απλά μόρια. Ωστόσο, το Sn1 μπορεί να εμφανιστεί με ογκώδη μόρια, ενώ το Sn2 δεν μπορεί επειδή είναι πολύ συμφορημένο για τον μηχανισμό που είναι γνωστός ως «πίσω επίθεση». Εξαιτίας αυτού, εάν επιθυμείτε μια αντίδραση Sn1, μπορεί να χρησιμοποιηθεί ένα ογκώδες μόριο για να βεβαιωθείτε ότι η αντίδραση Sn2 δεν θα συμβεί.
Περαιτέρω ανάγνωση
- Εντολή ομολόγου έναντι μήκους ομολόγου
- Ενέργεια ομολόγων
- Άνθρακας




