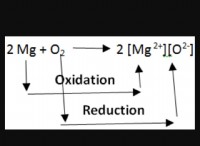
Ποια είναι η διαφορά μεταξύ δύο χημικών τύπων;
1. Ταυτότητα των ατόμων:
* Διαφορετικά στοιχεία: Η πιο θεμελιώδης διαφορά είναι ότι οι τύποι μπορεί να περιέχουν διαφορετικά στοιχεία εξ ολοκλήρου. Για παράδειγμα, το H₂O (νερό) και το CO₂ (διοξείδιο του άνθρακα) έχουν εντελώς διαφορετικά στοιχεία.
* διαφορετικός αριθμός ατόμων: Ακόμη και αν οι τύποι έχουν τα ίδια στοιχεία, μπορούν να έχουν διαφορετικούς αριθμούς από κάθε άτομο. Για παράδειγμα, το H₂O (νερό) και το H₂O₂ (υπεροξείδιο του υδρογόνου) περιέχουν τόσο υδρογόνο όσο και οξυγόνο, αλλά το υπεροξείδιο του υδρογόνου έχει δύο άτομα οξυγόνου αντί για ένα.
2. Μοριακά έναντι εμπειρικών τύπων:
* Μοριακός τύπος: Αυτός ο τύπος δείχνει τον ακριβή αριθμό ατόμων κάθε στοιχείου σε ένα μόριο. Παραδείγματα περιλαμβάνουν H₂O, CO₂ και C₆H₁₂O₆ (γλυκόζη).
* Εμπειρική φόρμουλα: Αυτός ο τύπος δείχνει την απλούστερη αναλογία ατόμων ολόκληρου αριθμού σε μια ένωση. Για παράδειγμα, η εμπειρική φόρμουλα γλυκόζης (c₆h₁₂o₆) είναι ch₂o.
3. Δομική φόρμουλα:
* Δομική φόρμουλα: Αυτός ο τύπος δείχνει τη διάταξη των ατόμων μέσα σε ένα μόριο, συμπεριλαμβανομένων των τύπων δεσμών μεταξύ τους. Παρέχει πιο λεπτομερείς πληροφορίες σχετικά με τη δομή του μορίου απ 'ό, τι μόνο τη μοριακή ή εμπειρική φόρμουλα.
4. Συμπυκνωμένος τύπος:
* συμπυκνωμένος τύπος: Αυτός ο τύπος είναι μια στενογραφία της μοριακής φόρμουλας, που συχνά χρησιμοποιείται για να απλοποιήσει τη σύνταξη μεγάλων μορίων. Για παράδειγμα, η συμπυκνωμένη φόρμουλα για την αιθανόλη είναι ch₃ch₂oh.
Παράδειγμα:
Εξετάστε τους ακόλουθους τρεις τύπους:
* c₂h₆o (μοριακός τύπος)
* ch₃ch₂oh (συμπυκνωμένος τύπος)
* ch₃ch₂oh (δομική φόρμουλα)
Όλοι αυτοί οι τύποι αντιπροσωπεύουν το ίδιο μόριο, αιθανόλη . Διαφέρουν με το πόσο λεπτομέρειες παρέχουν σχετικά με τη δομή του μορίου.
Συνοπτικά, δύο χημικοί τύποι μπορεί να διαφέρουν στα στοιχεία που περιέχουν, τον αριθμό των ατόμων κάθε στοιχείου, τον τύπο του τύπου (μοριακό, εμπειρικό, δομικό κ.λπ.) ή το επίπεδο λεπτομέρειας που παρέχουν σχετικά με τη δομή του μορίου