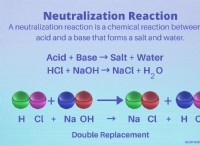
Είναι το σημείο βρασμού των ομοιοπολικών ενώσεων υψηλό ή χαμηλό;
* αδύναμες διαμοριακές δυνάμεις: Οι ομοιοπολικές ενώσεις συγκρατούνται μαζί με σχετικά αδύναμες διαμοριακές δυνάμεις, όπως οι δυνάμεις διασποράς του Λονδίνου, οι αλληλεπιδράσεις διπολικού-δίπολου και οι δεσμοί υδρογόνου. Αυτές οι δυνάμεις είναι πολύ πιο αδύναμες από τους ιοντικούς δεσμούς που βρίσκονται σε ιοντικές ενώσεις.
* Χαμηλή ενέργεια που απαιτείται για να σπάσει τα ομόλογα: Δεδομένου ότι οι διαμοριακές δυνάμεις είναι αδύναμες, απαιτείται λιγότερη ενέργεια για να τους ξεπεράσει και να διαχωρίσει τα μόρια. Αυτό έχει ως αποτέλεσμα ένα χαμηλότερο σημείο βρασμού.
Εξαιρέσεις:
Ενώ πολλές ομοιοπολικές ενώσεις έχουν χαμηλά σημεία βρασμού, υπάρχουν εξαιρέσεις:
* μεγάλα μόρια: Οι ομοιοπολικές ενώσεις με μεγάλα σύνθετα μόρια μπορούν να έχουν σχετικά υψηλά σημεία βρασμού. Αυτό οφείλεται στο γεγονός ότι έχουν περισσότερη επιφάνεια, οδηγώντας σε ισχυρότερες δυνάμεις διασποράς του Λονδίνου.
* δεσμός υδρογόνου: Οι ομοιοπολικές ενώσεις που μπορούν να σχηματίσουν δεσμούς υδρογόνου (π.χ. νερό, αλκοόλες) έχουν σημαντικά υψηλότερα σημεία βρασμού από παρόμοιες ενώσεις που δεν μπορούν να σχηματίσουν δεσμούς υδρογόνου. Αυτό οφείλεται στο γεγονός ότι οι δεσμοί υδρογόνου είναι ιδιαίτερα ισχυρές διαμοριακές δυνάμεις.
Σε αντίθεση:
Οι ιοντικές ενώσεις, λόγω των ισχυρών ηλεκτροστατικών αλληλεπιδράσεων τους, έχουν γενικά πολύ υψηλά σημεία βρασμού.
Παράδειγμα:
* νερό (h₂o): Μια ομοιοπολική ένωση με σχετικά υψηλό σημείο βρασμού (100 ° C) λόγω σύνδεσης υδρογόνου.
* μεθάνιο (ch₄): Μια ομοιοπολική ένωση με πολύ χαμηλό σημείο βρασμού (-161,5 ° C) λόγω μόνο των ασθενών δυνάμεων διασποράς του Λονδίνου.
* Χλωριούχο νάτριο (NaCl): Μια ιοντική ένωση με πολύ υψηλό σημείο βρασμού (1413 ° C) λόγω ισχυρών ηλεκτροστατικών αλληλεπιδράσεων.